
As células estaminais ‘induzidas’ fazem avanços emocionantes
Células estaminais de doentes com HD: tornando-se ferramentas importantes para investigadores – e agora corrigindo a mutação HD no laboratório

Tem cuidado: Tradução automática – Possibilidade de erros
Para divulgar notícias sobre a investigação em DH e actualizações de ensaios ao maior número de pessoas possível e o mais rapidamente possível, este artigo foi traduzido automaticamente por IA e ainda não foi revisto por um editor humano. Embora nos esforcemos por fornecer informações exactas e acessíveis, as traduções da IA podem conter erros gramaticais, interpretações erradas ou frases pouco claras.Para obteres a informação mais fiável, consulta a versão original em inglês ou volta mais tarde para veres a tradução totalmente editada por humanos. Se detectares problemas significativos ou se fores um falante nativo desta língua e quiseres ajudar a melhorar as traduções exactas, não hesites em contactar-nos através de editors@hdbuzz.net
As células estaminais são uma fonte de grande entusiasmo para doentes que sofrem de doenças causadas pela morte de células no corpo – como a doença de Huntington. Mas o diabo está nos detalhes, e usar efetivamente estas células poderosas para ajudar doentes com HD é um problema complexo. Agora, dois novos estudos avançaram as células estaminais como ferramenta para investigadores, e provam que é possível – em células numa placa – corrigir a mutação que causa HD.
Revisão das células estaminais
Todos os humanos começaram como um único óvulo fertilizado, que se divide repetidamente para formar os aproximadamente 50 biliões de células encontradas no humano adulto. Cada célula tem as suas próprias propriedades – as células musculares funcionam de forma muito diferente das células da pele, e assim por diante. As propriedades especiais de cada tipo de célula determinam que funções essa célula pode desempenhar.
Crédito da imagem: PNAS
Durante muitos anos, os cientistas acreditaram que apenas um tipo muito especial de célula – chamada célula estaminal – era capaz de se dividir e dar origem aos diferentes tipos de células nos nossos corpos. A fonte mais óbvia destas células eram os embriões em estágio inicial, onde normalmente são encontradas. Embora estas ‘células estaminais embrionárias’ fossem extremamente poderosas – permitindo aos cientistas cultivar novas células como células cerebrais no laboratório – o seu uso era ética e legalmente difícil porque exigia a destruição de embriões.
Em 2006 tudo o que sabemos sobre células estaminais mudou, quando Shinya Yamanaka descobriu a capacidade de ‘re-programar’ qualquer célula adulta numa célula estaminal. De repente, não havia necessidade de destruir embriões para criar células estaminais – podíamos simplesmente recolher uma pequena amostra de pele e re-programar células encontradas na pele para se tornarem células estaminais. Os cientistas tornaram-se bastante bons a cultivar neurónios, células musculares e outros tipos críticos de células que são danificadas em várias doenças a partir de células estaminais, uma vez que as têm.
Estas células reprogramadas são chamadas células estaminais pluripotentes induzidas, ou células iPS.
O nosso guia básico de células estaminais reviu anteriormente o entusiasmo e as dificuldades da investigação de células estaminais para a doença de Huntington.
Células estaminais de doentes com HD
Num artigo acabado de publicar na revista com nome ligeiramente estranho ‘Cell Stem Cell’, um grupo colaborativo de cientistas fez e estudou um conjunto destas células estaminais pluripotentes induzidas de doentes com HD. Os investigadores estavam curiosos sobre se as células estaminais de doentes com HD se comportariam de forma diferente das de pessoas que não têm a mutação.
O grupo de cientistas observou como as células se comportavam no laboratório. Várias décadas de trabalho sugeriram que as células de doentes com HD são anormais, mas ninguém nunca conseguiu estudar células estaminais neste nível de detalhe antes, porque têm sido tão difíceis de obter.
Acontece que as novas linhagens de células estaminais criadas a partir de doentes com doença de Huntington agem de forma diferente das células estaminais criadas a partir de pessoas sem HD. As principais diferenças foram como as células ligavam e desligavam genes e como produziam energia.
Estes sintomas celulares correspondem em grande parte às observações que os cientistas fizeram noutros tipos de células com a mutação da doença de Huntington, sugerindo que estas novas células estaminais serão uma ferramenta realmente útil para compreender como a mutação altera a função das células, levando eventualmente à sua morte precoce na HD.
Qual é o objetivo disto? O que podem os doentes com doença de Huntington esperar destas novas linhagens celulares? A contribuição mais importante das células estaminais de doentes com HD é a provisão de um modelo para cientistas que estudam a doença.
Imagina que és uma empresa farmacêutica que acredita que o teu novo medicamento vai ajudar as células a lidar com a mutação da doença de Huntington e manter-se saudáveis por mais tempo. Agora, graças a estas novas células estaminais, podes testar o teu medicamento em células cerebrais feitas a partir de doentes reais com HD, em vez de células de um rato ou de um verme. Esperamos que isto forneça resultados muito mais precisos – e nos ajude a testar apenas medicamentos realmente eficazes nas pessoas.
Substituição celular?
Um sonho para muitos investigadores, e pessoas que vivem com a doença de Huntington – é que possamos um dia substituir células perdidas por novas – permitindo-nos parar, ou talvez até reverter, sintomas de doenças degenerativas.
Cultivar novas células para substituir aquelas perdidas numa doença é conhecido como terapia de substituição celular, e é uma das razões para todo o entusiasmo em torno das células estaminais. Alguns investigadores acreditam que transplantar células estaminais para as partes danificadas do cérebro de doentes com HD poderia substituir aquelas células que morrem durante o curso da doença.
Grandes desafios científicos terão de ser conquistados antes que a terapia de substituição celular possa funcionar. Primeiro, que células devemos colocar nos cérebros das pessoas? Obviamente, gostaríamos de substituir as células cerebrais moribundas por mais células cerebrais, não células da pele ou células musculares. Então, onde conseguimos mais células cerebrais, e como garantimos que são uma ‘correspondência’ genética para o doente?
É aqui que entram estas novas células estaminais ‘induzidas’; pela primeira vez poderíamos teoricamente recolher uma amostra de pele de um doente com HD, reprogramar as células para se tornarem células estaminais ou neurónios, e injetar essas células estaminais no próprio cérebro do doente. Se funcionasse, esta seria uma opção fantástica porque as células seriam uma correspondência genética exata para o doente.
Experiências recentes usando um rato sugerem que células estaminais injetadas desta forma podem formar novas células cerebrais que parecem integrar-se no cérebro e ajudar ratos a recuperar de danos cerebrais.
Corrigindo a mutação HD
Leitores atentos podem ter notado um problema aqui – a mutação que causa HD é encontrada em cada célula do nosso corpo, incluindo as nossas células da pele e quaisquer células estaminais que fazemos a partir delas. Então, mesmo que enfrentemos com sucesso os desafios técnicos de entregar células estaminais no cérebro, ficamos presos com novos neurónios que têm a mesma mutação que causa HD em primeiro lugar!
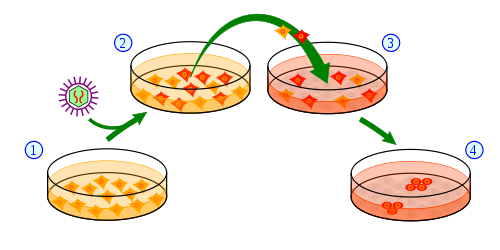
A solução ideal para este problema seria se pudéssemos ‘reparar’ as células estaminais de doentes com HD removendo a mutação que causa HD, enquanto as células estavam a crescer numa placa. Existem algumas técnicas muito novas para fazer exatamente isto – cobrimos anteriormente uma tecnologia, chamada nucleases de dedos de zinco. Mas estas tecnologias são novas, e provavelmente estão a muitos anos de aplicação em doentes com HD.
Um grupo de cientistas liderado por Lisa Ellerby no Buck Institute for Research on Aging considerou outra abordagem para este problema. Fazer mudanças precisas nos genes de células estaminais crescendo numa placa é muito, muito mais fácil do que mudar o ADN de pessoas vivas. Na verdade, o processo é rotineiramente usado para fazer os ratos geneticamente modificados usados para estudar biologia e medicina em laboratórios ao redor do mundo.
O grupo de Ellerby fez uma experiência muito simples – deram às células estaminais de um doente com doença de Huntington um pouco de ADN extra que lhes disse como fazer um gene HD normal, em vez de mutante.
A eficiência deste procedimento é extremamente baixa: de 5 milhões de células tratadas, apenas 2 células usaram o ADN extra para fazer a correção apropriada. Mas usando um marcador brilhante para rotular aquelas células que realmente fizeram a correção, elas puderam ser isoladas e cultivadas.
Este truque genético simples permitiu a Ellerby e ao seu grupo fazer um conjunto incrível de comparações. Puderam fazer perguntas como, qual é a diferença entre uma célula com uma mutação HD, e exatamente a mesma célula com a mutação corrigida? A sua equipa, como o consórcio de células estaminais, olhou para as décadas de trabalho sobre HD em células e investigou o que aconteceu às células HD que foram ‘reparadas’. Esta análise revelou que algumas das anormalidades nas células HD podem ser corrigidas reparando a mutação HD.
Problema resolvido?
Isto fornece informação importante aos cientistas que estudam a doença de Huntington. Mas pode ser igualmente importante para resolver o problema do tratamento: como conseguimos que novas células sejam adequadas para substituir células perdidas na HD?
Voltando a este problema agora, podemos ver que é agora possível, em teoria, reprogramar células da pele de um doente com HD em células estaminais. Essas células estaminais poderiam então ser geneticamente ‘corrigidas’, removendo a mutação que causa HD do seu genoma. A implantação dessas células geneticamente modificadas permitiria, em teoria, que novos neurónios crescessem no cérebro do doente, livres da mutação HD.
Aqui no HDBuzz, estamos satisfeitos com a velocidade destes avanços nas células estaminais, e as possibilidades para tratamentos de HD. Mas também consideramos que desenvolver estes saltos notáveis em tratamentos para HD ainda será um processo muito longo e difícil – na verdade, muito mais difícil do que desenvolver um medicamento tradicional.
Entregar células geneticamente modificadas nos cérebros de doentes vivos é muito arriscado, e terá de ser abordado com grande cautela. Há provavelmente muitos anos de ensaios laboratoriais cada vez mais sofisticados que precisam de ser conduzidos antes que este método de tratamento seja usado em larga escala nas pessoas.
Num prazo muito mais curto, porém, estes avanços importantes nas células iPS são provavelmente ferramentas muito úteis para compreender a doença de Huntington e agilizar o processo de desenvolvimento de medicamentos. Entretanto, as células estaminais como tratamentos estão a mover-se lentamente ao longo do pipeline de terapias em desenvolvimento para HD. À medida que outros tratamentos com prazos mais curtos passam por ensaios, é crítico começar o desenvolvimento nestas tecnologias de prazo mais longo mas extremamente promissoras.
Aprende mais
- Publicação original do Consórcio HD iPSC na Cell Stem Cell (artigo completo requer pagamento ou subscrição)
- Publicação original de An, Ellerby e colegas na Cell Stem Cell sobre a correção do defeito genético nas células estaminais HD (artigo completo requer pagamento ou subscrição)
- A nossa revisão do campo das células estaminais para doentes com HD
- Nucleases de dedos de zinco, uma possível forma de corrigir mutações do ADN
- Neurónios de células estaminais: fazendo as ligações certas
Fontes e Referências
Para mais informações sobre a nossa política de divulgação, consulte as nossas FAQ…


