
Conferência sobre Terapêuticas para a Doença de Huntington 2023 – Dia 1
Veja as atualizações de investigação do Dia 1 da Conferência sobre Terapêuticas para DH 2022 #HDTC2023.
Olá de Dubrovnik, Croácia, onde a Conferência CHDI de Terapêuticas 2023 irá decorrer de segunda-feira, 24 de abril, a quinta-feira, 27 de abril!
Esta conferência é importante para os investigadores de DH em todo o mundo, provenientes da indústria, academia e organizações sem fins lucrativos. Dezenas de cientistas apresentarão palestras sobre todos os aspectos relacionados com a DH, desde a genética, terapêuticas até às novidades em ensaios clínicos.
A equipa editorial do HDBuzz estará presente a partir da manhã de terça-feira, 24 de abril, a publicar tweets em tempo real sobre as palestras científicas e atualizações sobre o progresso dos ensaios clínicos. As nossas atualizações no Twitter estão compiladas abaixo. Continue a acompanhar as atualizações em tempo real ao longo da conferência com a hashtag #HDTC2023.
Para um resumo da conferência do último ano, comece aqui: https://en.hdbuzz.net/320 Publicaremos resumos em formato de artigo para cada dia da conferência.
Saber o que precisamos de saber
A primeira palestra da manhã será dada pela Dra. Vahri Beaumont, da CHDI, que dará uma visão geral do que ainda não compreendemos sobre a DH e do que precisamos saber para desenvolver terapêuticas mais eficazes. Ela começará por abordar a história da nossa compreensão da genética da DH e das alterações cerebrais, desde as repetições de CAG até à perda de células cerebrais e circuitos, que os cientistas começaram a entender através do estudo de doações de tecido cerebral humano e de imagens cerebrais.
Já sabemos há algum tempo que pessoas com DH que têm o mesmo número de repetições de CAG podem começar a apresentar sintomas em idades diferentes. Uma das razões para isso são outras diferenças genéticas no código de ADN de uma pessoa. Os cientistas estão a estudar essas alterações nas letras do ADN para compreender melhor como podem alterar o início da DH e também podem ser exploradas para desenvolver novos medicamentos para a DH. Muitas dessas outras diferenças genéticas afetam a “instabilidade somática”, na qual a mutação CAG que causa a DH sofre ainda mais mutações em algumas células cerebrais, tornando-se ainda mais longa. Repetições longas de CAG no gene huntingtina levam a uma proteína huntingtina expandida, que ao longo do tempo pode ser tóxica para diferentes partes das células cerebrais. Vahri lembra-nos que ainda há muito que não compreendemos sobre a sequência exata de eventos que ligam a expansão do gene HTT aos sintomas que as pessoas com DH experienciam.
Por exemplo, ainda não está claro qual exatamente é o produto do gene HTT que desempenha o papel fundamental na doença – é a molécula mensageira? A proteína? Aglomerados de proteínas? Talvez todos desempenhem um papel na DH. Outra questão sem resposta é se a cópia “defeituosa” da huntingtina está a causar problemas, ou se a perda de uma cópia “boa” deixa as células cerebrais sem alguma função. Independentemente dessas questões, várias abordagens terapêuticas que visam a genética da DH já estão a ser testadas na clínica. Algumas concentram-se na huntingtina total, tanto normal quanto expandida; outras visam apenas a forma expandida.
A boa notícia é que existem muitas empresas a testar todo o tipo de abordagens na clínica, testando diversas hipóteses. Talvez a combinação dessas terapias possa ser a melhor forma de tratar a DH. Graças à generosidade das doações cerebrais de pessoas com DH após o seu falecimento, os cientistas continuam a fazer avanços para compreender a doença nas pessoas, utilizando essas amostras de tecido muito preciosas.
Os cientistas estão a utilizar a tecnologia mais avançada para compreender o que está a acontecer com as mensagens da huntingtina e a proteína em diferentes tipos de células e por que certos tipos podem ser mais vulneráveis. Utilizando diversos modelos animais, os investigadores estão a construir uma imagem mais precisa do que acontece dentro do cérebro durante a DH e de como podemos intervir. Os modelos animais também permitem testar intervenções, como medicamentos, em estágios muito iniciais da DH.
Vahri destaca que existem algumas limitações nos modelos de ratos, que não mostram todos os sintomas da DH em pessoas. Os cientistas estão a continuar a desenvolver e utilizar múltiplos modelos para testar da melhor forma os medicamentos antes de serem usados em pessoas na clínica.
Um dos maiores objetivos na investigação da DH é poder iniciar o tratamento antes do início dos sintomas. Isso não é fácil, mas um sistema de classificação muito estratégico, o HD-ISS https://en.hdbuzz.net/325, ajudará os cientistas a alcançar esse objetivo.
Partilha de dados
O Dr. David Howland, da CHDI, está a introduzir a primeira sessão oficial de partilha de dados da conferência. Esta sessão irá focar-se no ADN da huntingtina e em como a nossa compreensão da sua estrutura pode informar o desenvolvimento de terapias.
Interrupções no ADN
O primeiro a apresentar é o Dr. Galen Wright, da Universidade de Manitoba, que irá discutir como pequenas variações no gene da huntingtina afetam o curso da DH. O ano de 2023 marca o 30º aniversário do mapeamento do gene da DH, a huntingtina. Este gene é MUITO extenso. Muito maior do que a maioria dos outros genes do nosso corpo, o que pode dificultar o estudo pelos cientistas.
Galen está a recapitular o que aprendemos sobre o gene da DH, a tendência das repetições de CAG de se expandirem em algumas células cerebrais ao longo do tempo (instabilidade somática) e os outros genes que influenciam essa expansão.
Três letras de ADN codificam um único aminoácido, a unidade de construção das proteínas. CAG codifica para glutamina. Curiosamente, CAA também codifica para glutamina e verifica-se que a maioria das pessoas com DH tem uma “interrupção” de CAA nos seus CAGs. Pessoas que não têm essa interrupção de CAA no seu gene da huntingtina desenvolvem a doença muito mais cedo na vida, apesar de a proteína codificada pelo gene ser exatamente a mesma. Isso acontece muito raramente, mas sugere que há algo importante no código de ADN na DH. Os cientistas pensaram que essas interrupções de CAA iriam alterar a forma como o gene da huntingtina poderia mudar através da instabilidade somática, mas descobriu-se que esse não é o caso. Isso significa que ainda há mais trabalho a fazer para compreender o que está a acontecer.
Quando as pessoas se submetem a testes preditivos, é medida a extensão total das repetições de CAG. Embora pequenas alterações nas letras do ADN possam ter um grande impacto nos sintomas da DH, ainda não chegámos ao ponto de medir isso em indivíduos para compreender a probabilidade de início precoce ou tardio. Curiosamente, existem outras doenças causadas por alterações nas letras do ADN no gene da huntingtina, incluindo a síndrome de Rett e outra doença chamada LOMARS. Estas doenças também afetam o sistema nervoso central, tal como a DH.
A equipa de Galen explorou grandes conjuntos de dados abertos que reúnem informações sobre associações genéticas provenientes de vários estudos, não necessariamente focados na DH. Eles descobriram que o gene da huntingtina está ligado a características como envelhecimento e sintomas psicológicos. Isso significa que o gene da huntingtina é provavelmente importante em várias funções das nossas células nervosas e que a biologia da huntingtina é complexa. Galen salienta com razão que, quanto mais aprendemos, mais perguntas surgem sobre a huntingtina.
Dissecando a reparação do ADN
A seguir, temos a Dra. Anna Pluciennik, da Universidade Thomas Jefferson. O laboratório da Anna estuda como ocorrem as mutações no nosso código de letras do ADN e como estas podem levar a doenças. As mutações são causadas por danos no ADN, que ocorrem cerca de 50.000 vezes por dia! Desenvolvemos muitas formas de reparar o ADN para evitar a acumulação de mutações.
A equipa da Anna estuda um tipo específico de reparação do ADN chamado reparação mis-match, que corrige uma situação em que as duas cadeias da hélice de ADN não têm a correspondência apropriada, fazendo com que a estrutura da hélice fique um pouco desalinhada. Estas estruturas desalinhadas são reconhecidas por maquinaria especial que tenta corrigir esses problemas para corrigir o código de letras do ADN. Ironicamente, em alguns casos (como nas repetições de CAG), essa maquinaria acaba por piorar as coisas.
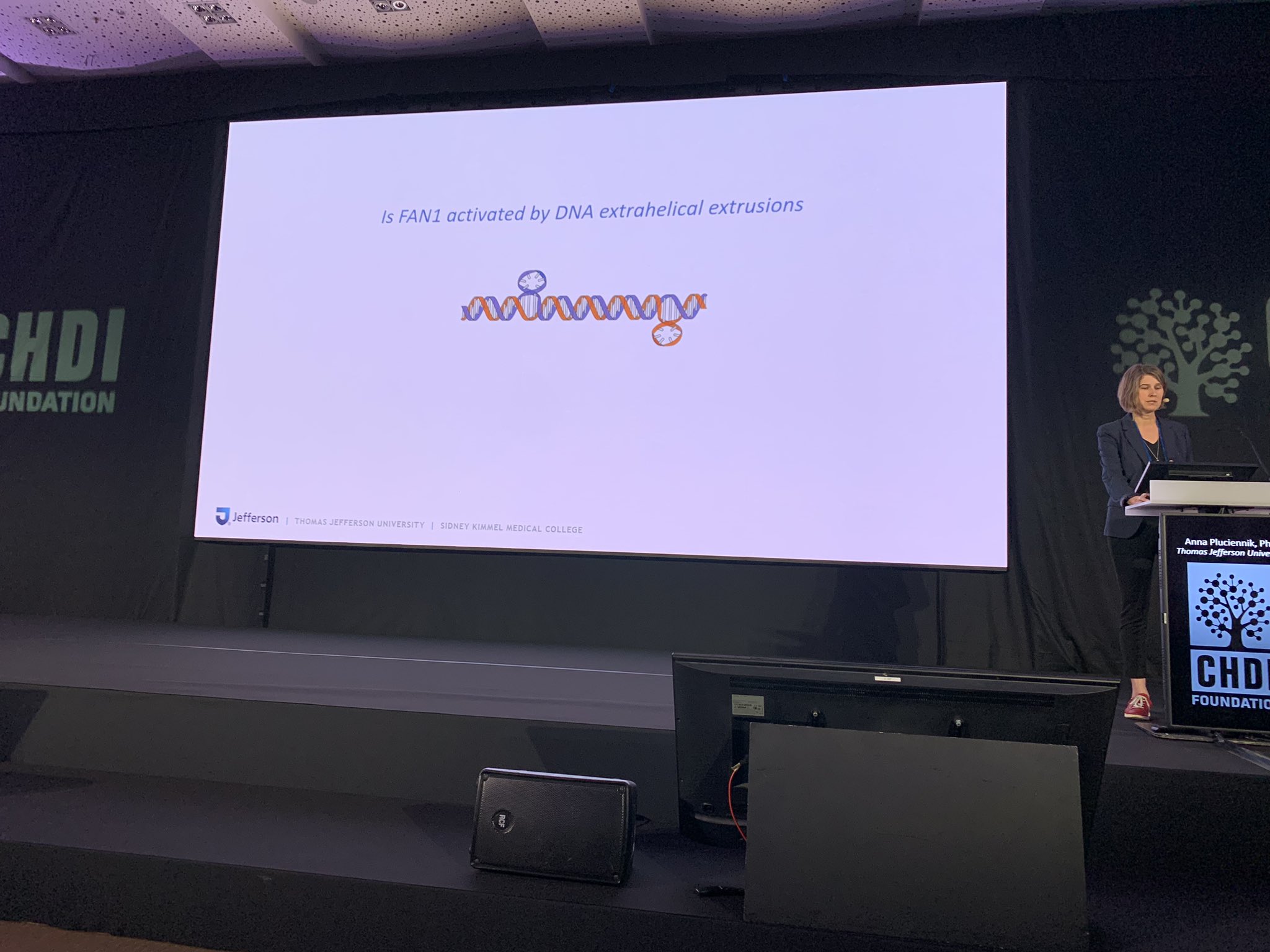
O laboratório da Anna estuda a bioquímica e ela comparou isso a desmontar um carro em milhares de peças para entender como todas elas funcionam em conjunto. Isso permite que a sua equipa descubra detalhes que nem sempre podem ser observados em culturas celulares complexas ou em modelos animais. No seu laboratório, a equipa da Anna cria um modelo para a mutação da DH para entender como a maquinaria de reparação pode reconhecê-la e tentar corrigi-la. Ela estuda a expansão das repetições de CAG, que pode fazer com que se projetem para fora da hélice de ADN, numa estrutura conhecida como “extrusão”.
Usando este modelo, o laboratório da Anna está a analisar que proteínas de reparação do ADN fazem o quê. Este tipo de análise é importante para estudos futuros que possam visar essas proteínas com medicamentos que poderiam ajudar no tratamento de pessoas com DH. O trabalho da Anna está a ajudar a compreender como diferentes quantidades de cada proteína podem alterar o equilíbrio para decidir se a maquinaria corrige os danos do ADN como deveria, ou inadvertidamente piora as coisas.
A estrutura do ADN influencia a função
A última palestra desta primeira sessão da manhã é da Dra. Natalia Gromak, da Universidade de Oxford. A equipa da Natalia estuda estruturas especiais chamadas R-loops, que podem ser importantes na DH. Os R-loops são formados quando a cópia mensageira do código de ADN, chamada ARN, está a ser produzida. Se a cópia mensageira do ARN interage com o ADN como um fecho de correr, forma uma espécie de bolha no ADN.
Estas estruturas têm papéis importantes em certas funções nas células, mas também podem interferir com coisas, causando doenças, por isso devem ser equilibradas cuidadosamente. Desde muito cedo, estabeleceu-se uma ligação entre os R-loops e doenças neurodegenerativas, incluindo a Esclerose Lateral Amiotrófica (ELA). O grupo da Natalia gerou uma lista de proteínas que interagem com as estruturas dos R-loop, na esperança de compreender os seus papéis na biologia e como esses papéis podem dar errado, causando doenças. Mais de 50 doenças possuem sequências repetitivas de ADN que estão expandidas, tal como na DH.
O laboratório Gromak descobriu que os R-loops são formados em regiões com ADN repetitivo e têm estudado os R-loops na ataxia de Friedreich. A questão para esta conferência, é claro, se os R-loops desempenham um papel na DH. O grupo da Natalia descobriu que existem mais R-loops em células sanguíneas de pacientes com DH e encontraram o mesmo resultado em neurónios portadores da mutação da DH cultivados numa placa. Há também mais danos no ADN em ambos os tipos de células. As próximas questões para a equipa são se os R-loops se formam na sequência repetitiva no gene da DH, se eles podem afetar a expansão adicional desta região (instabilidade somática) e se a redução da huntingtina tem algum efeito nos R-loops observados em células de DH.
CRISPR e DH
A seguir a uma pausa para café, é o Dr. Michael Brodsky, da UMass Chan Medical School. O laboratório de Michael utiliza tecnologias CRISPR que podem ser aplicadas no laboratório para fazer edições muito precisas das sequências do ADN genómico. Visar a causa fundamental da DH, a expansão CAG no gene da huntingtina, é a forma mais sensata de tratar a doença, mas isso é mais fácil dizer do que fazer. A edição genética seria uma forma de o fazer, mas tivemos de esperar que a tecnologia chegasse lá.
Há 10 anos, tudo isto era apenas um sonho distante, mas as tecnologias têm melhorado tão rapidamente que agora estamos a estudar seriamente a edição genética como uma possível terapia para a DH, o que é muito entusiasmante! Michael destaca que a edição genética é permanente, portanto, é necessário ter muito cuidado para garantir que não ocorram alterações indesejadas. Outro desafio no uso da edição genética para a DH é que o fármaco tem de ser administrado nas células neuronais, o que não é tarefa fácil. A edição genética também deve ser muito precisa. Isso significa que idealmente apenas o gene da huntingtina expandida é alvo, de forma a haver alterações limitadas ou inexistentes no gene da huntingtina normal – o que também é um grande desafio.
O grupo do Michael está a adotar duas abordagens para editar especificamente o gene da huntingtina expandida. A primeira é direcionar o tratamento a pequenas alterações de letras (chamadas SNPs) no restante ADN do gene da huntingtina, que tendem a estar associadas à versão expandida. O laboratório de Brodsky está a realizar essas experiências em vários modelos de ratos com DH, cujos resultados sugerem que eles são capazes de editar especificamente apenas o gene da huntingtina expandida – ótimas notícias!
Uma abordagem alternativa na edição específica do gene da huntingtina expandida é, na verdade, reduzir o tamanho da expansão CAG de volta ao intervalo normal. O grupo do Michael tem tido sucesso ao fazer isso em ratos com DH e em células em placas de cultura. Ainda há alguns detalhes a serem ajustados antes que isso possa ser desenvolvido como um potencial tratamento para a DH, mas eles estão cautelosamente otimistas de que trabalhos adicionais ajudarão a definir um caminho a seguir.
Mais CRISPR e DH!
A próxima palestra, do Dr. Ben Kleinstiver de Harvard/MGH, também se foca na edição do ADN. Ele lidera um grupo de desenvolvimento de tecnologia genómica que está a trabalhar em como alterar a expansão de repetições de CAG e, eventualmente, criar terapêuticas.O laboratório de Ben concentra-se nas diversas formas pelas quais o CRISPR pode ser usado para fazer diferentes tipos de alterações no ADN. Eles estão a ajustar a maquinaria CRISPR para personalizar ainda mais essas alterações.
A sua questão principal de investigação é: “que ferramentas de edição genómica podem ser usadas para alterar ou encurtar as repetições de CAG?” O laboratório adota diferentes abordagens para cortar as repetições, interrompê-las ou substituir letras ou sequências de ADN individuais. Porque o CRISPR evoluiu como uma forma de as bactérias combaterem ataques de vírus, ainda existem algumas limitações no uso da maquinaria CRISPR para tratar doenças. O grupo do Ben está a trabalhar na superação dessas limitações para permitir um melhor acesso a diferentes partes do gene da DH. As técnicas incluem o uso de diferentes tipos de enzimas de corte de ADN ou de substituição de letras, e a aplicação de diferentes métodos para direcioná-las às sequências de ADN. Em seguida, medem se as repetições de CAG ficam mais curtas. O objetivo é ajustar a edição e personalizá-la para o gene da huntingtina.
Esta é a primeira conferência de Ben sobre DH! É entusiasmante ver como os especialistas em CRISPR estão a direcionar os seus esforços para a DH. À medida que as tecnologias continuam a avançar, esperamos que possam ser aplicadas em futuras terapêuticas humanas.
Ainda mais CRISPR!
A seguir temos Kathryn Woodburn, da Life Edit Therapeutics, que irá fazer a última palestra antes do intervalo para almoço. A Kathryn trabalha em tecnologias de edição seletivas para a cópia expandida do gene da huntingtina. A Life Edit Therapeutics está a investigar como diferentes versões da maquinaria CRISPR, especialmente as encontradas em plantas, podem ser usadas para personalizar a edição do gene da huntingtina expandida.
A sua abordagem para o tratamento da DH consiste em utilizar vírus para entregar a sua maquinaria de edição ao cérebro. Até agora, eles testaram isto em diferentes tipos de ratos com DH, utilizando diferentes versões e doses dos seus fármacos de edição genética. Conseguiram reduzir os níveis da proteína huntingtina prejudicial em 40%, mantendo a proteína saudável intacta! Para obter especificidade em relação ao gene da huntingtina expandida, a sua abordagem consiste em apontar para assinaturas específicas de ADN que são encontradas apenas na versão expandida do gene. A Life Edit Therapeutics está a analisar algumas assinaturas diferentes para fazer isso e, até agora, os dados parecem promissores.
Garantir que não existam efeitos indesejados fora do alvo é uma tarefa desafiadora, e os cientistas da Life Edit estão a trabalhar para resolver isso o mais rapidamente possível. Isto conclui a sessão da manhã!
Modificadores Genéticos na DH
A sessão da tarde do dia um focar-se-á nos progressos feitos no estudo de modificadores genéticos em DH.
Compreender MSH3 em DH
Estudos genéticos em larga escala em seres humanos, conhecidos como GWAS, têm permitido aos investigadores identificar esses modificadores genéticos, ou seja, outros genes que influenciam o momento em que os sintomas da DH começam. A primeira palestra será proferida pelos cientistas da CHDI, Dan Felsenfeld e Tasir Haque, que nos vão contar tudo sobre o grande esforço da sua equipa no estudo de um gene identificado no GWAS chamado MSH3, e como poderão desenvolver fármacos direcionados para esta proteína.
O MSH3, como se poderá lembrar das palestras anteriores, reconhece segmentos desalinhados de ADN que precisam de ser corrigidos. A expansão de CAG no gene da huntingtina tem tendência a criar esses segmentos desalinhados, e acredita-se que a atividade do MSH3 no gene da huntingtina possa aumentar inadvertidamente o número de repetições de CAG nas células cerebrais (instabilidade somática). Os cientistas acreditam que o MSH3 poderia ser um bom alvo para medicamentos, uma vez que a inativação desse gene parece ser benéfica em modelos animais de DH, reduzindo a instabilidade somática – a expansão do número de CAG – no gene da huntingtina.
Desativar completamente um gene é bastante desafiador de fazer em seres humanos, portanto, em vez disso, os cientistas estão a desenvolver fármacos chamados “moléculas pequenas”, que potencialmente poderiam ser administrados por via oral, com o objetivo de impedir que o MSH3 funcione tão bem nas células. A equipa de Dan considerou diferentes formas de inibir o MSH3 e criou uma caixa de ferramentas de materiais e protocolos para estudar as suas moléculas pequenas. Isso ajudará outros investigadores que esperam desenvolver fármacos direcionados para o MSH3. Para desenvolver melhores fármacos, é útil ser capaz de “ver” a proteína MSH3. Usando técnicas engenhosas, é possível criar modelos tridimensionais da proteína, e os cientistas podem então observar onde e como a sua molécula se liga.
Agora, Tasir Haque está a apresentar algumas animações que se focam em diferentes partes da proteína MSH3 e onde os fármacos se encaixam. Muitas formas sinuosas que têm um grande significado para os biólogos estruturais! Usando esses modelos, eles podem descobrir como melhorar estes moléculas de fármacos em estágios iniciais de desenvolvimento para se ajustarem melhor a todas as saliências e reentrâncias da superfície da proteína MSH3, o que deve melhorar as suas propriedades.
Fármacos que têm o MSH3 como alvo
A seguir é Caroline Benn da LoQus23 Therapeutics, uma empresa que também está a trabalhar no desenvolvimento de fármacos direcionados ao MSH3 – é uma área em alta! A LoQus23 está a adotar uma abordagem ligeiramente diferente do programa MSH3 da CHDI – eles estão a criar moléculas que têm como alvo uma região diferente da proteína. Isto é uma boa notícia para o campo da DH, pois é ótimo poder testar múltiplas abordagens! Embora a sua abordagem de direcionar diferentes regiões do MSH3 seja mais difícil, eles conseguiram e encontraram duas séries de moléculas muito potentes e seletivas, o que significa que se ligam muito fortemente à proteína MSH3 sem afetar outras proteínas.
A LoQus23 também estabeleceu uma forma de medir a instabilidade somática em células em cultura para testar o quão bem as suas moléculas funcionam. Estas são experiências complexas que levam semanas desde o início até à conclusão. Eles também poderão usar esta plataforma para encontrar novos alvos, além do MSH3, que desempenham um papel semelhante nesta parte da reparação do dano no ADN, que é tão importante na DH.
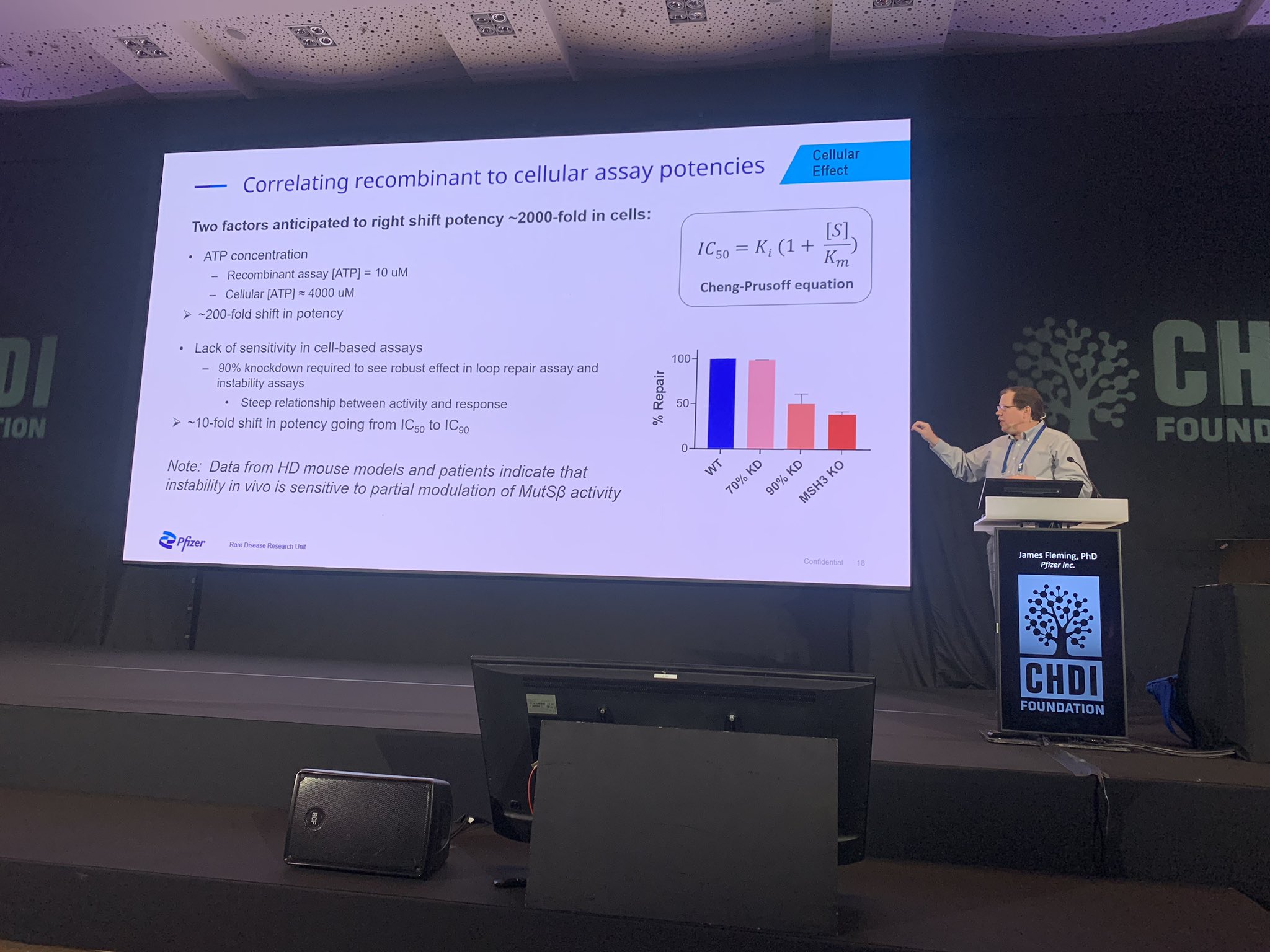
A seguir temos James Fleming da Pfizer. Esta empresa também está a desenvolver medicamentos que têm como alvo a via envolvendo o MSH3. A Pfizer está a adotar uma abordagem semelhante à da equipa da CHDI e, tal como os outros participantes, desenvolveu um conjunto de ferramentas e métodos para testar as suas moléculas quanto à capacidade de impedir a expansão de repetições de CAG.
Como outras empresas farmacêuticas, a Pfizer segue uma série de etapas para avaliar potenciais novos medicamentos, compreender como interagem com as proteínas que visam e, em seguida, testá-los em células e animais. Também eles estão a utilizar modelos tridimensionais e testes químicos para mostrar que os seus medicamentos conseguem ligar-se ao complexo proteico do qual a MSH3 faz parte, o que os tem ajudado a melhorar cada vez mais essas moléculas ao longo do tempo. O próximo passo é testar esses medicamentos em células cultivadas em laboratório. Grande parte deste trabalho está focado nos detalhes minuciosos da química, estrutura e energia das proteínas. Dito isto, as matemáticas têm um papel importante no processo de desenvolvimento de medicamentos!
Para trazer esses estudos para animais e, posteriormente, para humanos, será necessário um medicamento com as propriedades adequadas: a capacidade de atingir o MSH3, a capacidade de ser metabolizado pelo corpo e a capacidade de atravessar a barreira cerebral. Não é uma tarefa fácil! Após compreender melhor as propriedades de um novo medicamento em células e animais, ele poderá ser testado quanto à segurança em seres humanos. No momento, isso ainda está um pouco distante para todos os compostos apresentados hoje, mas é animador ver que as empresas estão a avançar com esse trabalho.
Bases de dados gigantescas para identificar marcadores genéticos
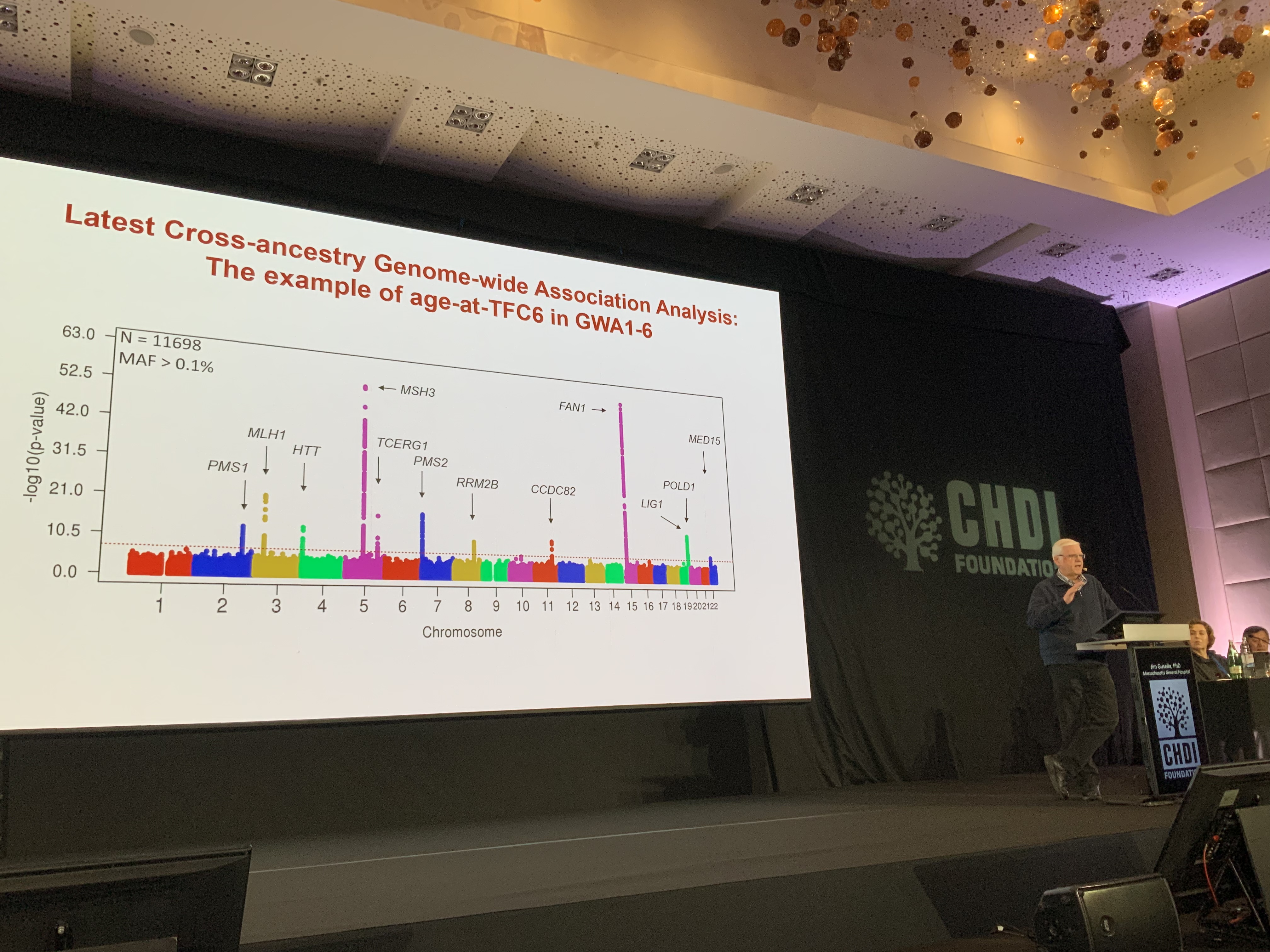
Iniciando a última sessão do dia, temos Jim Gusella da Universidade de Harvard, que irá falar sobre os modificadores genéticos da DH em nome de um grande consórcio de cientistas que estudam a genética da DH.
O Jim começa a sua apresentação reconhecendo todas as famílias afetadas pela DH que generosamente partilharam os seus dados e amostras com os investigadores ao longo dos anos, sem as quais essas análises em larga escala não seriam possíveis. Uma descoberta interessante que já conhecemos há algum tempo é que pessoas com o mesmo número de CAG podem começar a ter sintomas em idades muito diferentes. Os modificadores genéticos são marcadores no ADN que podem explicar esse início precoce ou tardio dos sintomas.
Cada vez mais evidências apontam para um determinante específico do início e da velocidade com que a DH piora ao longo do tempo: a expansão das repetições de CAG em algumas células. Esse processo, conhecido como instabilidade somática, parece estar diretamente relacionado com os modificadores genéticos. O poder desses estudos de modificadores advém do número de amostras de pacientes que são analisadas – mais dados significam conclusões com maior confiança. No estudo mais recente, foram analisados os dados de 11698 participantes, o que é incrível!
Um problema na investigação da DH, e na ciência em geral, é que muitas das amostras analisadas são de europeus ou pessoas de ascendência europeia. Neste conjunto de dados mais recente, a equipa está a trabalhar para incluir um grupo mais diversificado de pacientes nos dados. Com uma quantidade tão vasta e diversa de dados, é possível ter uma visão mais abrangente em grande escala e fazer previsões gerais sobre como os modificadores genéticos – pequenas alterações em outros genes – afetam o momento em que as pessoas com DH podem atingir certos estadios da doença.
É importante enfatizar que esta é uma forma de ter mais confiança sobre que outros genes afetam mais a DH nas pessoas. Isto é diferente de ser capaz de prever o início ou o curso da doença numa pessoa individual com DH. A equipa de Jim e o consórcio genético também estão a investigar como diferenças subtis e “interrupções” na sequência de CAGs no gene da huntingtina afetam a estrutura do ADN e a tendência das repetições de se tornarem instáveis e crescerem mais. A boa notícia deste conjunto de dados mais recente é que o MSH3, o tema da sessão anterior, continua a ser um modificador muito significativo de acordo com todas as análises utilizadas por Jim e seus colegas. Isso confere muita credibilidade a todas estas abordagens que visam a instabilidade somática e que tentam interromper a expansão da repetição de CAG ou diminuí-la.
Expansões de CAG em células específicas
A seguir temos Nathaniel Heintz, da Universidade Rockefeller, que irá falar sobre o seu trabalho de compreensão dos genes que são ativados ou desativados na DH. O laboratório Heintz desenvolveu uma série de técnicas que permitem aos cientistas “separar” os núcleos de muitas células diferentes e analisar as mensagens genéticas em vários tipos de células. Isto tornou-se uma forma importante de estudar por que certas células são mais vulneráveis na DH e em outras doenças. Essas análises utilizam amostras de tecido cerebral post-mortem, possibilitadas pela incrível generosidade da comunidade da DH.
O estriado, uma área localizada no centro do cérebro, é profundamente afetado pela DH. A equipa de Heintz consegue separar diferentes tipos de células no estriado e descobriu que a expansão da repetição de CAG ocorre com maior frequência num tipo de célula, os neurónios espinhosos médios.
Há muito tempo que sabemos que os neurónios espinhosos médios (MSNs) são perdidos em grande número na DH. Existem diferentes tipos de MSNs e, estranhamente, descobriu-se que tanto os que são vulneráveis na DH como os que sobrevivem estão sujeitos à expansão da repetição de CAG. A razão pela qual estes neurónios espinhosos médios parecem ter níveis mais elevados de expansão pode dever-se aos níveis mais elevados de MSH3 encontrados nessas células, mas essa ligação ainda não está comprovada. Os neurónios espinhosos médios também possuem um grande número de genes que são ativados ou desativados na DH – 1000 ativados e 500 desativados! Muitos dos genes afetados estão envolvidos na reparação do dano ao ADN – reforçando mais uma vez o papel importante que isso provavelmente desempenha na DH.
Trabalhos em curso estão a abordar as questões de quando os neurónios espinhosos médios são afetados na DH e como intervir da melhor forma. Também estão a analisar outras áreas do cérebro e a ir camada por camada para entender exatamente que tipos de células estão a ser danificadas ou perdidas.
Velocidade de expansão de CAG
O último orador do dia é Steve McCarroll, de Harvard. O laboratório de Steve estuda que genes são ativados ou desativados a nível da célula individual, em vez de uma mistura geral de vários tipos de células – uma abordagem incrivelmente detalhada. Ele usa uma analogia de frutas para falar sobre o poder desta técnica – podem-se comparar tipos de células como diferentes tipos de bagas, o mesmo tipo de célula em diferentes pessoas como maçãs para maçãs, as diferenças entre diferentes células do mesmo tipo, como olhar para duas amoras.
A partir destas análises de células individuais, eles conseguem identificar que células desaparecem ao longo do curso da DH, confirmando descobertas anteriores de que os neurónios espinhosos médios e os neurónios de projeção espinhosos são os tipos mais vulneráveis de células nervosas. Eles também conseguem determinar exatamente que células apresentam expansões de CAG – isto parece sugerir que os neurónios espinhosos médios vulneráveis são os mais propensos a terem maior expansão. A expansão de CAG durante a vida de uma pessoa nestas células parece ser muito específica APENAS para o gene da huntingtina, e apenas para o gene da DH, não afetando outros genes que possuem códigos de ADN semelhantes. A maioria destas células cerebrais vulneráveis apresenta expansões moderadas na repetição de CAG, mas um pequeno subconjunto possui expansões enormes para as quais os cientistas ainda não descobriram a razão exata.
De acordo com os dados do laboratório de McCarroll, as expansões moderadas parecem ocorrer muito lentamente ao longo do tempo, mas as expansões mais exageradas ocorrem de forma muito mais rápida. A questão-chave é: a partir de que limite do número de repetições de CAG a velocidade de expansão aumenta, causando danos e morte dessas células nervosas vulneráveis? Para tentar descobrir isso, o laboratório de McCarroll pode comparar neurónios individuais com diferentes números de repetições de CAG e dividi-los em grupos para entender melhor que comprimentos são mais problemáticos. Eles agruparam as células pelo número de repetições de CAG e, estranhamente, não observaram muitas diferenças nos genes que se ativam e desativam em repetições de comprimentos mais baixos. As mudanças mais profundas ocorrem em células com repetições de CAG muito, muito longas, acima de 180.
McCarroll está a propor uma forma muito diferente de pensar na patologia da DH e como a doença progride ao longo do tempo. Há algumas conversas interessantes na plateia! Mas é por isso que é tão bom que todos estes cientistas possam reunir-se nesta conferência para debater todas estas ideias.
Acompanhe amanhã!
É tudo por hoje, pessoal. Vamos fazer uma pausa durante a noite, mas estaremos de volta amanhã de manhã! Lembrem-se de continuar a acompanhar as atualizações ao vivo para o resto da conferência com a hashtag #HDTC2023.
Para mais informações sobre a nossa política de divulgação, consulte as nossas FAQ…


