
Silenciamento genético para a DH: a história até agora
Será o silenciamento genético tão empolgante como parece para a DH, e o que poderá o futuro reservar?

Tem cuidado: Tradução automática – Possibilidade de erros
Para divulgar notícias sobre a investigação em DH e actualizações de ensaios ao maior número de pessoas possível e o mais rapidamente possível, este artigo foi traduzido automaticamente por IA e ainda não foi revisto por um editor humano. Embora nos esforcemos por fornecer informações exactas e acessíveis, as traduções da IA podem conter erros gramaticais, interpretações erradas ou frases pouco claras.Para obteres a informação mais fiável, consulta a versão original em inglês ou volta mais tarde para veres a tradução totalmente editada por humanos. Se detectares problemas significativos ou se fores um falante nativo desta língua e quiseres ajudar a melhorar as traduções exactas, não hesites em contactar-nos através de editors@hdbuzz.net
O silenciamento genético significa usar moléculas especialmente concebidas para ‘desligar’ a mensagem que faz as células produzirem a proteína huntingtina nociva. O nosso guia básico do HDBuzz sobre silenciamento genético explica as técnicas, os resultados até agora e os desafios futuros.
Recebemos muitos pedidos dos leitores para escrever um artigo sobre ‘silenciamento genético’ – também conhecido como ‘silenciamento da huntingtina’. É uma área de investigação que gera muito entusiasmo. A atenção de muitas pessoas foi atraída para o tema pelo recente comunicado de imprensa conjunto da Lundbeck e da Universidade de Massachusetts, anunciando uma colaboração de investigação destinada a desenvolver terapias de ‘interferência de RNA (RNAi)’ para a DH.
Então, o que é o silenciamento genético? Como funciona e como pode beneficiar os doentes com DH?

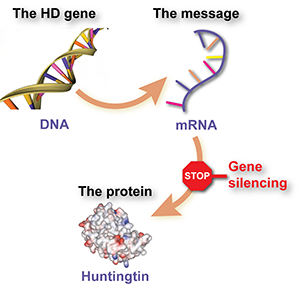
Genes, mensagens e proteínas
As proteínas são moléculas que atuam como pequenas máquinas, realizando a maior parte do trabalho útil dentro das células – coisas como fazer reações químicas funcionarem, comunicar mensagens, dar estrutura às células e assim por diante. Cada proteína diferente é feita usando um conjunto de instruções chamado gene. Os genes são feitos de ADN e vivem no centro de controlo da célula, o núcleo.
No entanto, os genes não são usados para fazer proteínas diretamente. Entre eles, a célula usa a sequência de ADN do gene como um modelo para fazer uma ‘molécula mensageira’ chamada ‘RNA mensageiro’ ou mRNA. A molécula mensageira mRNA é então usada para dizer à célula quais os blocos de construção a juntar para fazer a proteína.
Recapitulando, o ADN é usado como modelo para fazer uma mensagem de mRNA, e a molécula mensageira é então usada para construir moléculas de proteína.
A doença de Huntington é causada por um único gene anormal – o gene que diz às células para produzirem a proteína chamada huntingtina. Cada célula tem duas cópias de cada gene. A maioria das pessoas com DH, ou aquelas que a desenvolverão mais tarde, têm um gene ‘normal’ e um com demasiadas repetições da sequência de três letras ‘CAG’ perto do início. Esse simples ‘erro ortográfico’ resulta numa proteína ‘mutante’ que se comporta de forma diferente da proteína normal, danificando as células e produzindo os sintomas da DH.
Podes ter ouvido o termo ‘wild-type‘ – é assim que os cientistas chamam ao gene e à proteína não mutantes, ou ‘normais’.
Silenciando o gene da huntingtina
Uma vez que o gene anormal é a causa de todos os problemas na DH, por que não simplesmente eliminá-lo e substituí-lo por um gene saudável? Infelizmente, é pouco provável que isso funcione, porque as células têm formas muito seguras de proteger o ADN para evitar danos ou alterações.
Por outro lado, a molécula mensageira mRNA está a flutuar na célula e, enquanto estiver lá, continuará a ser usada para fazer mais moléculas de proteína. Se pudéssemos de alguma forma dizer à célula para ignorar essa mensagem, a proteína nociva não seria produzida. Esse é o pensamento por trás do ‘silenciamento genético‘. A ideia é que os cientistas poderiam criar um medicamento que é na verdade uma molécula mensageira especialmente concebida, que se liga à mensagem da huntingtina e diz à célula para se livrar dela.
O silenciamento genético parece bom demais para ser verdade, mas não é. Em 1998, dois investigadores, que mais tarde ganharam o Prémio Nobel de Medicina, descobriram como desligar genes individuais. Chamaram à sua técnica interferência de RNA (RNAi).
O silenciamento genético é agora uma técnica padrão usada pelos cientistas para estudar como os organismos funcionam, como as doenças causam danos e como uma forma de desenvolver tratamentos. Um medicamento de silenciamento genético (Vitravene, usado para tratar uma infeção viral ocular) está licenciado para uso humano, e mais de uma dúzia de ensaios estão em curso em muitas doenças diferentes, com mais a caminho.
Se fosse assim tão fácil, já teríamos comprimidos de silenciamento genético para a doença de Huntington, então qual é o problema? Bem, como com qualquer nova técnica, é natural que haja desafios, contratempos e obstáculos inesperados pelo caminho.
Desafio um: entrar no cérebro
Um dos principais problemas é fazer chegar as moléculas de silenciamento onde são necessárias. Na DH, a morte de células cerebrais chamadas neurónios é o principal problema, por isso precisamos de fazer chegar a molécula a essas células.
“Vários grupos diferentes de investigadores já relataram sucesso na redução da produção de huntingtina em modelos animais”
O primeiro obstáculo é fazer o medicamento entrar no cérebro. O cérebro tem um escudo defensivo natural para impedir que substâncias nocivas entrem nele a partir do sangue. Isso é bom para nós no geral, porque protege o cérebro, mas dá uma dor de cabeça aos investigadores de medicamentos para a DH, porque torna muito mais difícil fazer os medicamentos entrarem no cérebro do que, por exemplo, no fígado ou nos rins.
Portanto, é pouco provável que um simples comprimido ou injeção seja adequado para combater a DH com silenciamento genético. Uma forma de contornar este problema é usar bombas e tubos minúsculos para infundir o medicamento de silenciamento diretamente no cérebro ou no líquido que o rodeia – o líquido cefalorraquidiano ou LCR. Isso parece bastante assustador, e não há dúvida de que implantar bombas ou tubos no sistema nervoso é um grande passo, mas na verdade sistemas semelhantes já são usados para administrar medicamentos noutras doenças como a esclerose múltipla (EM) e o cancro cerebral, onde têm um historial de segurança muito bom.
Desafio dois: distribuição
Uma vez que o medicamento está no sistema nervoso, o problema da distribuição ainda não está resolvido. O cérebro é uma bola densa de tecido através da qual é difícil as moléculas de silenciamento se espalharem. Além disso, o tratamento precisa de entrar dentro das células para funcionar – flutuar entre as células não é suficiente.
Os cientistas estão a usar diferentes métodos para resolver este problema. Os vencedores do Prémio Nobel usaram moléculas de interferência de RNA (RNAi) para desligar genes. Estas são muito semelhantes às moléculas produzidas naturalmente pelas células. A desvantagem é que não tendem a espalhar-se naturalmente pelo cérebro e não são muito boas a entrar nas células.
Assim, os investigadores de RNAi tendem a usar tubos muito finos, inseridos na substância do cérebro, direcionados para as regiões mais afetadas, ligados a bombas que usam pressão para espalhar o medicamento mais longe. Outra opção é deixar as moléculas de RNAi ‘apanharem boleia’ dentro de vírus desativados, que são especialistas em espalhar-se pelo cérebro e injetar coisas nas células.
Outra abordagem é tentar moléculas diferentes que possam ser melhores a espalhar-se e a entrar nas células. Os oligonucleótidos antisense (ASOs) são semelhantes às moléculas de RNAi, mas são ligeiramente mais simples e não são produzidos naturalmente pelas células. O princípio é o mesmo – aderem à molécula mensageira de mRNA e impedem a célula de a usar para construir proteínas.
Os ASOs parecem ser muito melhores a espalhar-se por todo o cérebro e podem entrar nas células com bastante facilidade. Também parecem durar muito mais tempo – o que pode ser bom ou mau, dependendo de quão bem fazem o seu trabalho.
Qual técnica de silenciamento genético é melhor? Simplesmente não sabemos, por isso o RNAi e os ASOs estão a ser trabalhados ao mesmo tempo, para ver qual é o melhor.
Desafio três: desligar o gene
O teste-chave de um tratamento de silenciamento genético é se pode desligar o gene com sucesso. Até agora, a investigação em modelos animais de DH sugeriu fortemente que isto pode ser alcançado, tanto com tratamentos de RNAi como de ASO.
Em 2005, uma equipa de investigadores liderada por Bev Davidson em Iowa injetou moléculas de RNAi nos cérebros de ratos com DH e conseguiu uma redução de 85% na mensagem da huntingtina. A função motora e as anomalias celulares dos ratos também melhoraram. Desde então, vários grupos diferentes de investigadores relataram sucesso na redução da produção de huntingtina usando várias moléculas diferentes, incluindo medicamentos RNAi e ASO. O trabalho mais recente sugere que os benefícios de infusões mesmo curtas são mantidos por períodos bastante longos.
Desafio quatro: escolher o alvo certo
Os investigadores de medicamentos gostam de detetar problemas antecipadamente em vez de esperar que aconteçam, e um possível problema com o silenciamento genético são os seus efeitos na cópia natural ou wild-type do gene da huntingtina.
Sabemos que não ter huntingtina de todo é perigoso. Os ratos sem nenhuma cópia do gene morrem antes de nascerem. Então, a questão-chave é: será que a redução na huntingtina mutante necessária para tratar a doença causa uma redução na huntingtina wild-type que é perigosa?
Neste momento, não sabemos. Alguns investigadores acham que apenas pequenas reduções na huntingtina mutante serão suficientes para dar às células a hipótese de recuperar, por isso não precisamos de nos preocupar com os efeitos nocivos de reduzir ligeiramente a proteína wild-type. Outros acreditam que precisamos de desenvolver tratamentos que desligarão apenas a proteína mutante. Isso é chamado de silenciamento alelo-específico – um alelo é o que chamamos a cada uma das duas cópias de um gene.
O silenciamento alelo-específico parece muito sensato – se pudermos visar o gene mutante, por que não o faríamos? A desvantagem é que para visar apenas uma cópia de um gene, é preciso procurar no ADN de cada paciente diferenças individuais de ‘ortografia’ entre os dois alelos. Felizmente, essas diferenças são comuns, mas ainda assim provavelmente precisaríamos de vários medicamentos diferentes para poder fornecer tratamento direcionado ao maior número possível de pacientes. Alguns pacientes não têm diferenças de ortografia adequadas que possam ser visadas desta forma.
O debate sobre se o silenciamento alelo-específico é necessário está em curso, mas a boa notícia é que não teremos de esperar mais por uma resposta, porque ambas as técnicas estão a ser testadas agora mesmo por diferentes grupos de investigadores.
Desafio cinco: efeitos secundários
Os tratamentos de silenciamento genético ainda podem ter efeitos secundários, mesmo que os possíveis problemas com a redução da huntingtina wild-type possam ser evitados.
Um problema são os chamados ‘efeitos fora do alvo’, onde a molécula do medicamento adere e interfere com moléculas mensageiras de genes que não a huntingtina. Isso poderia produzir uma série de problemas.
Outra questão é que o sistema imunitário do cérebro pode acabar por combater as moléculas ‘alienígenas’ que estão a ser bombeadas para dentro dele, e isso poderia piorar as coisas.
Precisamos de levar estes possíveis efeitos secundários a sério agora, enquanto ainda estamos na fase de os testar em animais. Mesmo efeitos indesejados bastante leves poderiam ser más notícias, especialmente se o silenciamento genético acabar por ser usado durante muitos anos para prevenir sintomas em pessoas que tiveram um teste positivo.
Os cientistas estão a trabalhar para produzir as melhores moléculas com o menor risco de efeitos secundários graves, e apenas as mais seguras serão propostas para ensaios em humanos.
Quando, quando, quando?
A empolgação em torno do silenciamento genético é justificada, porque muitos investigadores acreditam que é a nossa melhor chance de produzir tratamentos eficazes para a DH. Claramente, há muitos problemas a resolver, mas com o passar dos anos, o progresso está a ser feito, e todos concordam que até agora nada foi encontrado que sugira que a técnica não funcionará em pacientes.
Neste momento, um ensaio de silenciamento genético com ASO está em andamento em pacientes com ELA (doença do neurónio motor). Isso é realmente importante porque está a testar não apenas o medicamento, mas também o sistema de entrega por bomba e tubo para levar o medicamento onde é necessário. Enquanto isso, muitos investigadores ao redor do mundo estão a descobrir quais moléculas serão as melhores para testar em pacientes com DH.
Não podemos afirmar com certeza quando os tratamentos de silenciamento genético estarão disponíveis para os pacientes, mas o HDBuzz ficaria desapontado se não víssemos ensaios de silenciamento genético em humanos para a DH num futuro muito próximo.
Aprende mais
Para mais informações sobre a nossa política de divulgação, consulte as nossas FAQ…


