Redireccionamento da proteína huntingtina no interior das células
Equipa canadiana descodifica os 'marcadores' que redireccionam a proteína huntingtina nas células
 Escrito por Dr Jeff Carroll 09 de Agosto de 2011 Editado por Professor Ed Wild Traduzido por Eliana Marisa Ramos Publicado originalmente a 26 de Junho de 2011
Escrito por Dr Jeff Carroll 09 de Agosto de 2011 Editado por Professor Ed Wild Traduzido por Eliana Marisa Ramos Publicado originalmente a 26 de Junho de 2011
A proteína huntingtina mutante causa a doença de Huntington, mas nem toda a huntingtina mutante é igualmente tóxica. O local exacto onde é encontrada no interior das células tem um impacto significativo sobre o modo como as células conseguem ou não lidar com a proteína mutante. Novos projectos de investigação estão a ajudar a entender os sinais que fazem com a huntingtina mutante se mova pela célula, fornecendo pistas sobre como torná-la menos tóxica.
Huntingtina - e a sua gémea do mal
Embora a doença de Huntington se deva a uma anomalia genética, sabemos que os danos causados às células se devem à proteína mutante. O gene da DH possui um conjunto de instruções para fazer a proteína huntingtina. Nos indivíduos com DH, e naqueles que estão destinados a desenvolver a doença, um ‘erro de ortografia’, no início das instruções genéticas, faz com que uma parte especial da proteína seja mais longa que o normal. Muitos blocos de construção chamados de ‘glutamina’ ficam agregados numa extremidade da proteína.

Ter muitos blocos de glutamina no início da proteína tem efeitos desastrosos, e é o que provoca os efeitos nocivos da huntingtina mutante.
Uma das principais tarefas dos investigadores da doença de Huntington é descobrir exactamente como a proteína mutante é diferente da normal, e como é que essas diferenças danificam as células. Cada informação nova sobre a forma como a proteína causa danos, é uma possível pista na pesquisa de tratamentos para retardar a doença.
Ray Truant é um investigador da doença de Huntington na Universidade McMaster em Ontário, Canadá. Truant e a sua equipa de cientistas têm estudado a proteína huntingtina desde há muitos anos e têm partilhado muitas ideias importantes sobre como esta funciona e o que acontece de errado na doença de Huntington.
O fragmento N-terminal
A huntingtina é uma proteína grande, por isso estudar a proteína toda de uma só vez é difícil. Depois do gene ter sido identificado em 1993, logo se descobriu que o pedaço mais prejudicial da proteína mutante se encontra perto do início. Os cientistas chamam a este bocado da huntingtina, que contém as glutaminas extra, ‘o fragmento N-terminal’.
Para além da região crítica que se encontra mutada na DH, este fragmento N-terminal da proteína huntingtina tem uma série de outras características interessantes. Os cientistas têm vindo a estudá-lo há quase 20 anos e continuam a encontrar uma série de propriedades inesperadas neste pequeno pedaço de proteína - propriedades que têm grande impacto nas células.
Linha de distribuição celular
O laboratório do Dr. Truant já tinha descoberto que os primeiros dezassete aminoácidos, os blocos de construção, parecem ser particularmente importantes. Eles comportam-se um pouco como uma ‘etiqueta de endereço’ para a proteína inteira.
Dependendo do que está a acontecer à célula, pequenos ‘marcadores’ químicos podem-se ligar aos primeiros dezassete aminoácidos, ou ser removidos. A maquinaria de transporte da célula pode, então, ler estes marcadores como um código de barras. Dependendo do padrão de marcação presente, a proteína huntingtina é direccionada para diferentes lugares na célula. Assim, apesar do facto destes dezassete aminoácidos serem apenas uma pequena porção da proteína huntingtina, podem ter um impacto enorme na localização e função da proteína.
O processo de adição e remoção desses pequenos marcadores é chamado de ‘modificação pós-tradução’. ‘Tradução’ é o processo de construção de proteínas usando as instruções do ADN nos nossos genes, por isso ‘pós-tradução’ significa apenas ‘depois de a proteína ter sido construída’.
Os números mágicos: treze e dezasseis
«Marcadores específicos sobre o décimo terceiro e décimo sexto aminoácidos da huntingtina ajudam a determinar se a proteína acaba ou não no núcleo. »
Compreender a modificação pós-tradução é realmente importante na DH, porque parece influenciar o quão prejudicial a proteína é. Por exemplo, em 2009, o grupo de William Yang na UCLA descobriu que a adição de dois desses marcadores preveniu o aparecimento de sintomas num modelo de ratinhos DH. Esses marcadores estavam ligados ao décimo terceiro e décimo sexto blocos de construção, aminoácidos, da proteína huntingtina.
Uma vez que esses dois marcadores químicos parecem ser cruciais para o quão tóxica é a proteína mutante, é importante compreendê-los mais detalhadamente. A equipa do Dr. Truant dedicou-se a tentar perceber o efeito desses dois marcadores no destino da proteína e na quantidade de danos que esta faz quando chega ao seu destino.
O que é que eles descobriram?
Primeiro, os investigadores estudaram a proteína em células vivas que crescem numa placa no laboratório. Eles alteraram as células geneticamente de modo a que apenas produzissem os primeiros dezassete blocos de aminoácidos da proteína huntingtina, a que eles chamaram de N17. O fragmento N17 da huntingtina foi ligado a uma proteína de medusa que emite a cor amarela. Isto permite que o fragmento N17 possa ser observado enquanto se move pelo interior das células.
A equipa do Dr. Truant descobriu que quando o fragmento curto da huntingtina foi marcado na décima terceira e décima sexta posição crítica, era muito mais provável que acabasse no núcleo das células.
O núcleo é uma parte realmente importante da célula - é onde o ADN é armazenado, copiado e lido. Muitos investigadores têm sugerido que a huntingtina é mais tóxica para as células quando consegue chegar ao núcleo. Mas também pode ser prejudicial quando está fora do núcleo, pelo que é importante descobrir onde é mais perigosa.
A equipa foi mais longe, mostrando que a huntingtina é encontrada em locais muito específicos dentro do núcleo. Desenvolveram também novas técnicas para olhar apenas para as versões com marcadores da proteína, em vez de todas as cópias sem ‘marcação’. Estas ferramentas vão ser muito úteis para futuros estudos nos quais se investiga o papel que este processo de ‘marcação’ desempenha na DH.
E medicamentos?
Este trabalho mostra que marcadores específicos sobre o décimo terceiro e décimo sexto aminoácidos da huntingtina ajudam a determinar se esta acaba ou não no núcleo. Isto leva à ideia de que medicamentos que alterem a ‘marcação’ destes aminoácidos podem ser capazes de reduzir os danos nas células.
Como é que um medicamento como esse funciona? Ou, na linguagem dos ‘caçadores de medicamentos’, o que seria o seu ‘alvo’?
Bem, os marcadores químicos ligam-se à huntingtina através de maquinaria proteica, as ‘cinases’. E são removidos por outro tipo de maquinaria, as ‘fosfatases’. As cinases são um pouco como agrafadores, enquanto as fosfatases são mais como removedores de agrafos.
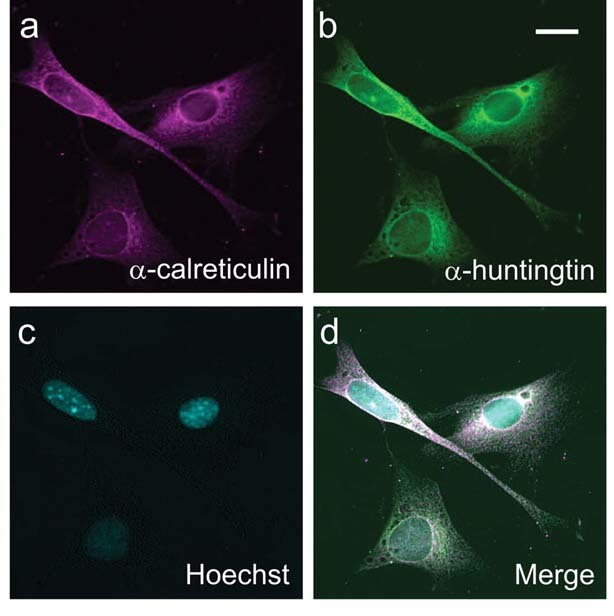
De acordo com o trabalho do Dr. Truant, medicamentos que reduzam a actividade da cinase, o ‘agrafador’, devem reduzir os marcadores na huntingtina, mantendo-a fora do núcleo. O próximo passo seria ver onde a proteína vai parar, e se isso a tornou mais ou menos tóxica.
Para testar esta abordagem, a equipa do Dr. Truant usou muitos medicamentos diferentes que são conhecidos por ter como alvo as cinases. Estes químicos ‘inibidores da cinase’ podem ajudar os cientistas a descobrir que cinase específica pode estar a marcar a sua proteína favorita. Ao bloquear uma cinase em particular, e usando em seguida as novas ferramentas que eles desenvolveram para procurar por huntingtina ‘marcada’, os investigadores podem descobrir quais as cinases que estão a fazer a ‘marcação’.
Depois de testar medicamentos que bloqueiam oitenta cinases diferentes, a equipa descobriu que uma cinase específica chamada ‘caseína cinase 2’- ou ‘CK2’ - era particularmente importante. Como esperado, os medicamentos que bloqueavam a CK2 fizeram com que a huntingtina fosse muito menos marcada nos sítios cruciais. Eles tinham o efeito de manter a huntingtina fora do núcleo, direccionando-a para a parte da célula onde está a ‘fábrica de proteínas’, o retículo endoplasmático ou ‘RE’. No processo, o dano causado às células pela proteína aumentou.
Espere, eles tornaram a proteína MAIS tóxica?
É claro que um medicamento que faz com que a huntingtina seja mais tóxica é o exacto oposto do que gostaríamos que acontecesse em pessoas. Por isso, não vá a correr à farmácia pedir um frasco de inibidores da CK2.
Se este trabalho vai originar tratamentos para os doentes de Huntington, vamos querer mais huntingtina marcada, não menos. Porém, nesta fase inicial, a equipa do Dr. Truant estava apenas a tentar descobrir que cinase seria o alvo mais poderoso.
Ao tornar as coisas piores nas células com medicamentos bloqueadores da CK2, eles foram capazes de confirmar que a CK2 é importante no processo de ‘marcação’ que estamos interessados. Trabalhos futuros podem agora ser direccionados para compreender como conseguir o efeito inverso e fazer huntingtina menos tóxica.
Este trabalho, realizado em células numa placa, está ainda longe de gerar tratamentos que possam ser usados em doentes. Mas é um passo importante, que nos ajuda a entender um dos principais intervenientes no dano celular na doença de Huntington, e abre uma nova porta para os investigadores que estão a trabalhar em futuros tratamentos.
Este artigo foi actualizado a 27 de Junho para esclarecer o efeito da ‘marcação’ e os medicamentos bloqueadores da CK2.